
 试验设计 选择48只6周龄、体重为200-250克的雄性Wistar大鼠,大鼠被单独安置在标准的笼子里,在12/12的黑暗/光照循环室内,温度控制在25℃,指定的食物和反渗透饮用水的供应不受限制;适应1周后,基线采血,所有大鼠被随机分为两组,正常饮食组(ND)和高脂饮食组(HFD);ND组大鼠饲喂标准实验室饲料,ND组大鼠饲喂标准实验室饲料,其中19.77%的能量来自脂肪;HFD被制成球形,其中59.28%的能量来自脂肪。在整个实验过程中,大鼠被饲喂指定的饮食24周;以前的研究表明,大鼠在12周的高脂饮食刺激后会诱发肥胖-胰岛素抵抗状态,因此在第12周采集血液,以确认肥胖-胰岛素抵抗状态;第13周,各组大鼠分为4个亚组(n=6/亚组)以接受特定的治疗。大鼠每天通过灌胃管口服载体(磷酸盐缓冲盐水,V)、益生菌(副干酪乳杆菌HII01 1×108 CFU/mL/天,PO)、益生元(10% XOS,PE)或合生元(益生菌和益生元1:1的组合,C),再持续12周,在第24周结束时采血并进行口服葡萄糖耐量试验(OGTT)。安乐死前7天和1天(即间隔6天),钙黄素溶液皮下注射到每只大鼠(10 mg/kg)进行动态骨组织形态分析。实验结束后,对大鼠进行深度麻醉,并断头处死,收集胫骨并进行骨组织形态学分析(见图1中的实验方案示意图)。
代谢参数分析:每周记录所有大鼠的体重(BW),在研究结束时,将大鼠处死后立即对内脏脂肪进行称重;禁食至少5小时后,从尾部侧静脉采集血液(在第0、12、24周),装入EDTA微离心管;在6000 rpm,4℃下离心10分钟,分离血浆,将所有的试管在-80℃下冷冻保存,直到进行生化分析;检测血浆葡萄糖、甘油三酯和胆固醇的浓度及血浆胰岛素。 口服葡萄糖耐量试验(OGTT):在第24周时进行实验,测试胰岛素敏感性。禁食12 h后给予2 g/kg BW葡萄糖灌胃,分别于给糖前和给糖后0、15、30、60和120 min采血,按照上述方法进一步测量血糖和胰岛素。 胰岛素抵抗的评估:通过平衡模型评估(HOMA)进行评估,HOMA用空腹血浆胰岛素和空腹血浆葡萄糖浓度的数学方程进行计算。 系统性炎症的测定:血清中的LPS水平被用来表示HFD喂养的啮齿动物的代谢性内毒素血症或系统性炎症,通过LAL检测进行量化。 骨组织形态学微结构分析:清除大鼠的右胫骨粘连肌、结缔组织及骨髓,之后在70、95和100% v/v的乙醇中脱水3天,将骨样嵌入甲基丙烯酸甲酯树脂中,在42℃下培养2天,用装有碳化钨刀片的旋转切片机对树脂包埋的骨样本进行纵向切割,厚度分别为7 µm和12 µm,用于静态和动态组织形态研究。静态组织形态测量:7微米的切片被处理为Goldner三色染色,随后在光镜下观察,获得的参数包括按组织体积归一化的骨小梁体积(骨体积分数;BV/TV,%)、骨小梁厚度(Tb.Th,µm)、骨小梁数量(Tb.N,mm-1)、骨小梁分离度(Tb.Sp,µm)、按骨表面归一化的成骨细胞表面(Ob.S/BS,%)、按骨表面归一化的破骨细胞表面(Oc.S/BS,%),以及按骨表面归一化的活性侵蚀表面(aES/BS,%);动态组织形态测量:在荧光显微镜下确定12 μm未染色切片的钙素标记双线,获得的参数包括按骨面归一化的双标记面(dLS/BS,%)、按骨面归一化的矿化面(MS/BS,%)、矿物质附着率(MAR,µm/day)和按骨面归一化的骨形成率(BFR/BS,µm3·µm-2·day-1)。 试验结果 (1)代谢参数和胰岛素敏感性 由表1可知,HFD喂养大鼠的体重显著高于ND喂养的大鼠;HFD喂养的大鼠血浆总胆固醇,特别是低密度脂蛋白升高;高胰岛素血症决定了HFD喂养大鼠的胰岛素抵抗,但血糖水平没有明显变化,且观察到HFD喂养大鼠的HOMA指数升高。
由表2可知,在研究结束时,经载体处理的HFD大鼠的肥胖-胰岛素抵抗仍持续存在;每天给这些大鼠服用益生菌、益生元和合生元,可使血浆总胆固醇、低密度脂蛋白、胰岛素水平以及通过OGTT测定的胰岛素敏感性恢复到载体处理的ND大鼠的水平;然而,与载体处理的HFD大鼠相比,这些治疗只降低了HFD大鼠的体重和内脏脂肪(P<0.05),所有的生物疗法均未改变ND大鼠的代谢参数,我们的数据表明,生物疗法减轻了HFD喂养大鼠的肥胖胰岛素抵抗。 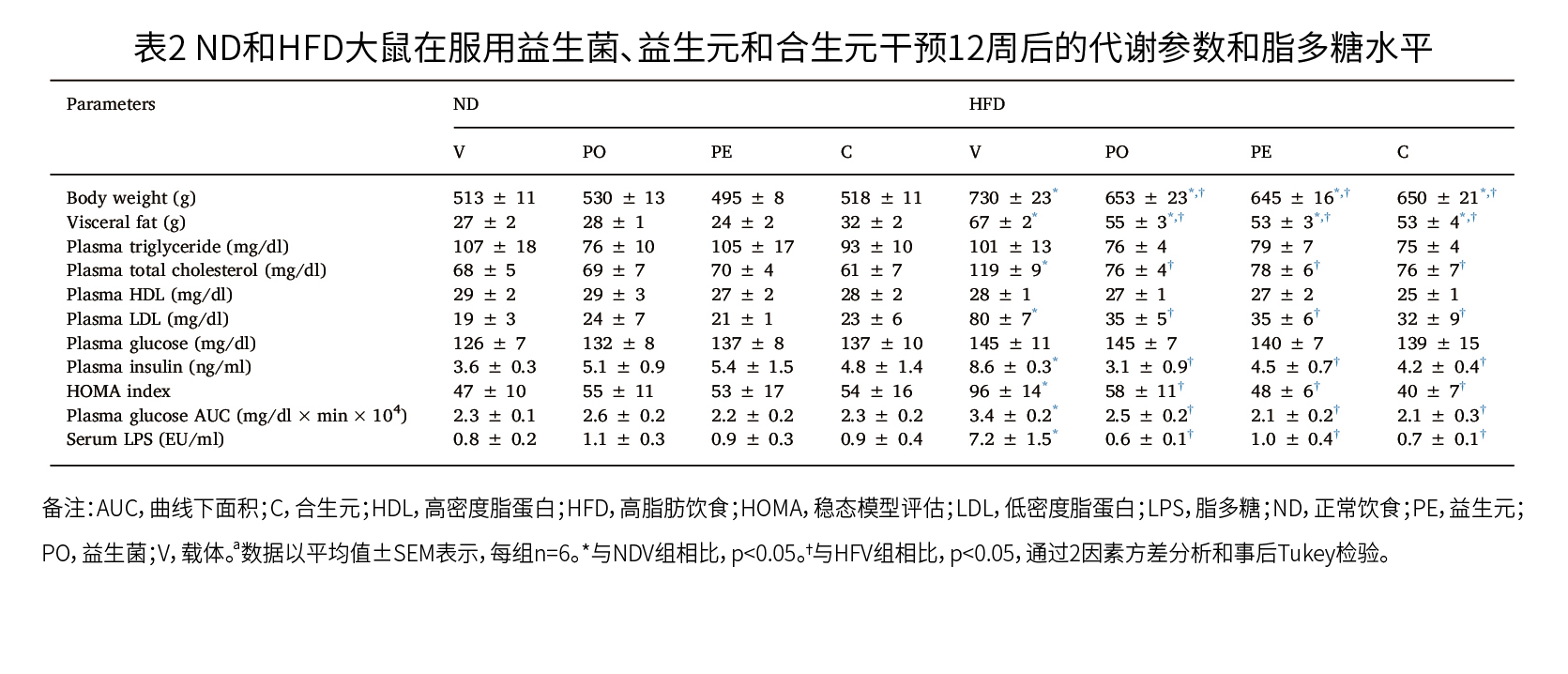 (2)全身性炎症 由表1可知,与ND大鼠相比,12周的高脂饮食导致LPS水平显著升高(P=0.001);由表2可知,在24周时,与用载体处理的ND大鼠相比,用载体处理的HFD大鼠其LPS水平仍然较高(P<0.001);尽管所有的生物处理都未影响ND大鼠的LPS水平,但与用载体处理的HFD大鼠相比,HFD大鼠的LPS水平显著下降(P<0.001),这些研究结果表明,L. 副干酪乳杆菌HII01、XOS及其合生元能减少HFD大鼠的全身性炎症。 (3)骨微结构参数 如图2所示,与其它所有组相比,在胫骨近端干骺端进行Goldner三色染色的代表性组织学图像显示,经载体处理的HFD大鼠的骨小梁更小、更薄;如图3和图4所示,图3A、3B显示,与载体处理的ND大鼠相比,载体处理的HFD大鼠的骨体积分数BV/TV和骨小梁厚度Tb.Th持续减少(P<0.05);然而,图3C、3D显示,在载体处理的HFD大鼠中,没有观察到骨小梁分离度Tb.Sp和骨小梁数量Tb.N的显著变化;图3A、3B显示,在ND大鼠中,给予副干酪乳杆菌HII01、XOS和合生元后没有显著的变化,但在HFD大鼠中,与载体处理的HFD大鼠相比,所有的治疗方法都可以改善BV/TV和Tb.Th(P<0.05)。
(4)成骨细胞/破骨细胞相关参数 如图4A所示,各组之间的Ob.S/BS没有任何显著差异;但图4B、4C显示,经载体处理的HFD大鼠的Oc.S/BS和aES/BS都有所增加(P<0.001)。补充副干酪乳杆菌HII01、XOS和合生元没有改变ND喂养大鼠的任何骨细胞参数,尽管与载体处理的HFD喂养的大鼠相比,它们显著减少了HFD大鼠的Oc.S/BS和aES/BS(P<0.01);然而,图4B、4C显示,与载体处理的ND大鼠相比,这些生物处理的HFD大鼠仍有Oc.S/BS和aES/BS的升高(P<0.05)。
(5)动态骨组织形态测量 如图5A所示,载体处理的HFD喂养的大鼠显示出两条绿色荧光线之间的距离最小,表明矿化活动最少,这些也与定量参数一致;图5B-5E显示,包括与载体处理的ND大鼠相比,在载体处理的HFD大鼠中dL.S/BS(按骨面归一化的双标记面)、MS/BS(矿化表面)、MAR(矿物附着率)和BFR/BS(按骨面归一化的骨形成率)显著减少(P<0.05);尽管所有的生物制剂对ND喂养的大鼠没有影响,但在HFD喂养的大鼠中,这些生物制剂类似地增加了所有这些动态参数,这些发现表明,服用副干酪乳杆菌HII01、XOS和合生元可以提高HFD诱导的肥胖-胰岛素抵抗大鼠的成骨细胞活性,从而增强骨形成。
试验结论 总之,副干酪乳杆菌HII01、低聚木糖和合生元改善了高脂饮食喂养大鼠的肥胖-胰岛素抵抗和全身性炎症,这些生物制剂同样增加了高脂饮食喂养大鼠的骨体积分数和骨小梁厚度,减少了破骨细胞表面和活性侵蚀表面,增加了双标记面、矿化面、矿物附着率和骨形成率,综上所述,这些生物制剂疗法可能通过减轻破骨细胞介导的骨吸收和促进成骨细胞诱导的骨形成来增强高脂饮食喂养大鼠的骨微结构。 参考资料: Eaimworawuthikul S,Tunapong W,Chunchai T,et al.Lactobacillus paracasei HII01, xylooligosaccharide and synbiotics improve tibial microarchitecture in obese-insulin resistant rats[J].Journal of Functional Foods,2019,59371-379. |