
试验设计 采用雄性Wistar大鼠作为试验研究对象,XOS纯度为95%,从玉米芯分离得到。将大鼠随机分为4组,HFD组(高脂饮食组,60%的能量来自脂肪)、HFD+XOS组(补充0.05 g/kg XOS的HFD组)、LFD组(对照组=低脂饮食组,10%的能量来自脂肪)和LFD+XOS组(补充0.05 g/kg XOS的LFD组),每组10只,干预12周。干预结束,安乐死,尸体剖检前用电子秤测定体重。 在尸检时,切除肝脏,用电子秤称重,肝脏脂肪含量通过生化和组织学方法测定的;收集盲肠内容物,用液氮快速冷冻并储存在-80°C,从盲肠内容物中提取细菌DNA,进行16S rRNA基因测序;收集附睾、肠系膜和皮下脂肪组织、肝脏和腓肠肌,用液氮快速冷冻并储存在-80°C,在冰冷的裂解缓冲液中进一步匀化组织,提取总蛋白,测定代谢酶活性,进行磷酸化蛋白的免疫印迹分析;从附睾和肠系膜脂肪组织以及肝脏中提取总RNA,通过定量实时PCR分析分析肝脏miRNAs和Actb mRNA以及脂肪组织Cd45 mRNA的表达水平;组织学分析的附睾脂肪组织样本,计算每只动物每个组织切片(切片面积25 ~ 35 mm2)中CLS的总数。 试验结果 (1)双向聚类 如表1所示,双向聚类确定了五组共同出现的代谢物和细菌属,与HFD组相比,HFD+XOS组大鼠粪便甘氨酸增加,次黄嘌呤、异戊酸、支链氨基酸和芳香族氨基酸减少,且补充XOS降低了与脂肪组织炎症和代谢功能障碍有关的菌属总丰度。
如图1a所示,在代谢物和SCFA双向聚类之间观察到最强的正相关,SCFA双簇中代谢物与异戊酸双向聚类中属的负相关最强,异戊酸双向聚类中含有大多数与HFD相关的属,这些菌属和代谢物聚集在一起,表明双向聚类确实反映了生物学意义;如图1b所示,高丰度的SCFAs、糖酵解标记物和“瘦”型微生物不仅与更瘦的表型和“更健康”的饮食有关,而且就脂肪含量而言,也与更好的肝脏健康有关。 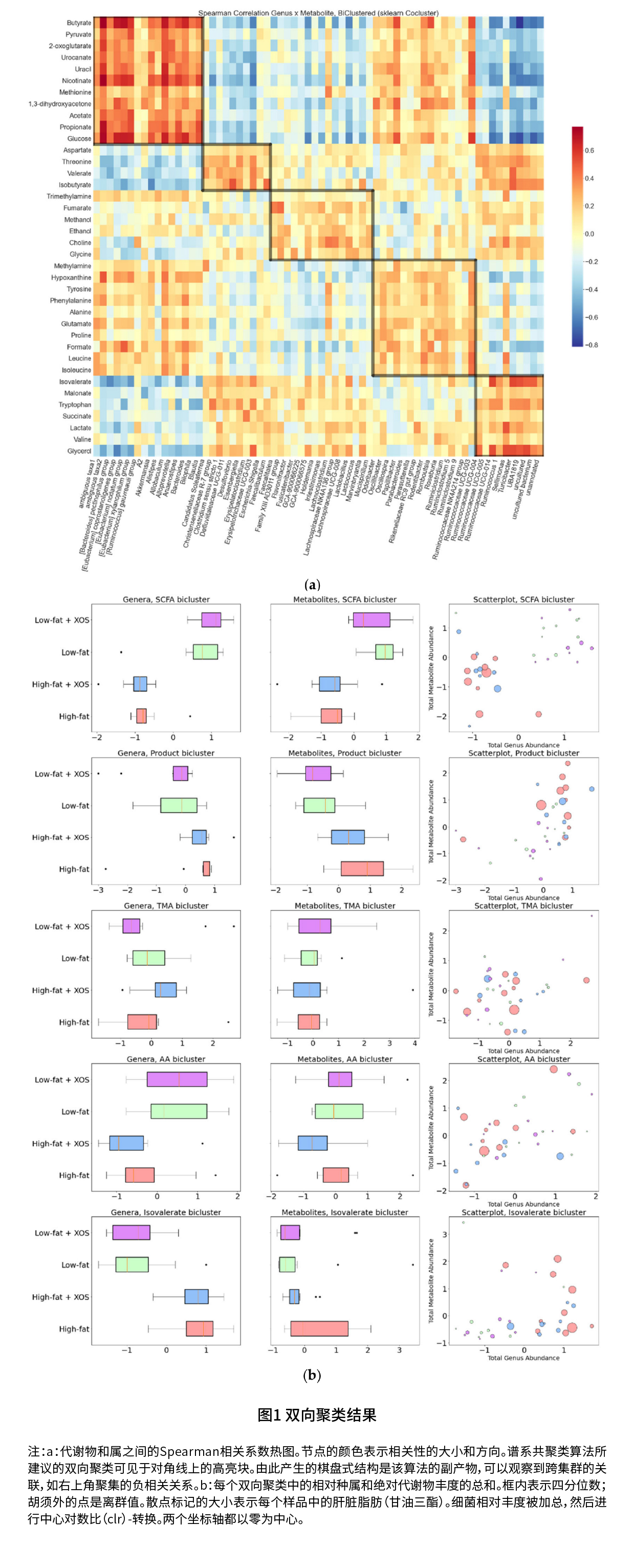 (2)饮食对肝脏MicroRNA的影响 如图2所示,与HFD组相比,HFD+XOS组的miR-192-5p(p=0.002)和miR-221-3p(p<0.001)的肝脏水平较低,而LFD组的miR-21-5p(p<0.001)的水平较高,同时miR-192-5p(p=0.001)和miR-221-3p(p<0.001)的水平也下降;与LFD组相比,LFD+XOS组降低了肝脏的miR-192-5p水平(p<0.001);与HFD+XOS相比,LFD+XOS组有更高的miR-21-5p水平和更低的miR-192-5p水平(两者的p<0.001)。
(3)饮食对肝脏中胰岛素信号的磷酸化和脂肪酸氧化相关蛋白的影响 如图3所示,在HFD中,补充XOS降低了ACC磷酸化,而在LFD中则增加,HFD组的ACC磷酸化低于LFD组,脂肪和XOS对ACC磷酸化有交互影响(F(1,0.012)=13.7,P=0.001);膳食脂肪(F(1,2.8×10-5)=6.8,p=0.013),而不是XOS,影响胰岛素受体底物1的抑制性Ser636/639磷酸化(p-IRS1),LFD组的磷酸化水平略低,膳食脂肪和XOS对pIRS1有交互影响(F(1,2.1×10-5)=5.7,p=0.022);XOS影响蛋白激酶B(p-AKT)的Thr308磷酸化(F(1,4.7×10-6)=4.5,p=0.040),不依赖膳食脂肪的情况下使其略有提高;膳食脂肪(F(1,0.006)=12.0,p=0.001),而不是XOS,影响细胞外信号调节激酶(p-ERK)的Thr202/Tyr204的磷酸化水平,且LFD组的磷酸化水平较低。
(4)饮食对脂肪组织炎症标志物的影响 如图4所示,根据附睾脂肪组织的组织病理学评分,膳食脂肪(F(1,140.237)=29.2,p<0.001)和XOS(F(1,28.463)=5.9,p=0.020)都减少了CLS的数量;在附睾(CD45-epi)(F(1,0.011)=18.1,p<0.001)和肠系膜(CD45-mese)(F(1,0.071)=15.1,p<0.001)脂肪组织中,LFD组的CD45 mRNA水平都高于HFD组;如图中所示的p值所示,在HFD上,XOS有减少CD45 mRNA的趋势。
(5)饮食对附睾和皮下脂肪组织中胰岛素信号的磷酸化、脂肪酸氧化和脂肪分解相关蛋白质的影响 如图5所示,在附睾脂肪组织中,膳食脂肪降低了(F(1,0.73)=24.5,p<0.001)p-ACC;膳食脂肪降低(F(1,0.09)=6.2,p=0.017)而XOS增加(F(1,0.051)=3.5,p=0.070)激活激素敏感脂肪酶的Ser660磷酸化(p-HSL);XOS轻微地增加了p-AKT(F(1,0.054)=6.9,p=0.012);在皮下脂肪组织中,LFD对p-ACC(F(1,0.151)=14.2,p=0.001)有增加的影响,但XOS对其没有影响,且没有发现饮食对AKT或ERK磷酸化的影响。
(6)饮食对代谢酶活性的影响 如图6所示,LFD增加了附睾脂肪组织中AST的活性(F(1,0.002)=8.7,p=0.006),而XOS降低了肠系膜脂肪组织中AST的活性(F(1,0.411)=7.9,p=0.009);膳食脂肪和XOS对皮下脂肪组织中AST的活性有交互影响(F(1,0.01)=12.4,p=0.001);补充XOS增加了附睾脂肪组织中ALT的活性(F(1,0.006)=4.7,p=0.018),且与膳食脂肪无关;在肠系膜脂肪组织中,膳食脂肪和XOS对β-HAD的活性存在交互作用(F(1,9.333)=14.5,p=0.001),而在皮下脂肪组织中,只有膳食脂肪对β-HAD的活性有增加作用(F(1,0.027)=4.7,p=0.037);LFD增加了附睾脂肪组织中CS的活性(F(1,0.024)=17.2,p<0.001),而在腓肠肌中,膳食脂肪和XOS对其活性有交互影响(F(1,6.649)=4.7,p=0.037)。
(7)双向聚类与生物标志物之间的相关性 如图7所示,最明显的是miR-221-3p、miR-192-5p、肝脏甘油三酯、CLS以及少量的p-IRS1-肝脏和p-ERK-肝脏与SCFAs、碳水化合物代谢标志物(所有P<0.05)和SCFA双向聚类中的“瘦型”属呈(所有P<0.05)负相关,这些生物标志物与产物双向聚类中的代谢物和属群以及异戊酸酯双向聚类中的属群呈正相关;相反,p-ACC-liver、CS-epidymal、AST-mesenteric、CD45和miR-21-5p与SCFA双向聚类中的特征呈正相关,与产物双向聚类中的特征和异戊酸酯双向聚类中的属呈负相关(所有P<0.05),没有一个生物标志物与TMA双向聚类中的代谢物总丰度明显相关,然而,AST-皮下、miR-215p和AST-附睾与TMA双向聚类的属呈负相关,而CLSs与TMA呈正相关(所有的P<0.05);异戊酸酯双向聚类中代谢物的总丰度与p-HSL-附睾、p-AKT-附睾和p-ACC-附睾呈负相关(均为p<0.05),与HFD+XOS组相比,HFD组的异戊酸盐显著升高,与肝脏甘油三酯、CLSs、miR-221-3p和miR-192-5p呈正相关(所有P<0.05),异戊酸盐还与miR-21-5p、p-ACC-肝脏、CD45epidymal、CS-epidymal、p-ACC-epidymal和p-AKT-epidymal呈负相关(所有的p<0.05)。
如图8所示,两组沿第一主成分有明显的差异,包含总方差的20.5%,这一变异的大部分是由miR-192-5p、miR-221-3p、AA双簇、异戊酸双簇、p-AKT-肾上腺、p-ERK-肝脏和p-HSL-肝脏解释的;AA和异戊酸酯双向聚类中的总代谢物丰度与miR-192-5p、miR-221-3p呈正相关,与AST-肠系膜、CLSs和肝脏甘油三酯有较少的关联,相反,它们与p-ERK-肝脏和p-HSL-附睾负相关,在AA双向聚类中的属倾向于与CLSs和肝脏甘油三酯共同变化。
如图9所示,在显著不同特征的PCA中,沿着解释总方差的31.4%观察到组别分离,甲胺与肝脏miRNAs和AST-mesenteric有强烈的正向变化,与pATK-epidymal和ALT-epidymal有负向变化;次黄嘌呤与CLSs、肝脏甘油三酯和p-AKT-epidymal共同变化;BCAAs(亮氨酸、异亮氨酸和缬氨酸)和芳香族氨基酸(苯丙氨酸和酪氨酸)与甘油三酯沿第一成分聚集,这解释了大部分组间变化,而甘氨酸与ALT-epidymal明显沿第二成分共同变化。
如图10所示,Oscillibacter、Bilophila和Ruminiclostridium5属,XOS干预后显著减少,也与肝脏甘油三酯和miRNAs有关;Escherichia-Shigella和Marvinbryantia在补充XOS后增加,并与p-AKT-epidymal共变,与CLSs、肝脏甘油三酯和miRNAs负相关。
试验结论 总之,本文研究了XOS对高脂饮食引起的大鼠肝脏脂肪变性的影响,补充XOS可使高脂饮食大鼠粪便中甘氨酸增加,次黄嘌呤、异戊酸、支链氨基酸和芳香族氨基酸减少,同时降低与脂肪组织炎症和代谢功能障碍有关的菌属总丰度。从附睾脂肪组织中CLSs的数量减少可以看出,XOS对肝脂肪变性的预防作用可能与脂肪组织炎症的减少有关,且伴随着肝脏和附睾脂肪组织中AKT磷酸化的增加,表明炎症减少与胰岛素信号的改善有关。以上结果表明,XOS对肝脏脂肪变性的预防作用与脂肪组织炎症的减少、胰岛素信号的改善以及某些共同出现的粪便代谢物和细菌属簇有关。 参考资料: Jukka Hintikka, Sanna Lensu, Elina Mäkinen, et al. Xylo-Oligosaccharides in Prevention of Hepatic Steatosis and Adipose Tissue Inflammation: Associating Taxonomic and Metabolomic Patterns in Fecal Microbiomes with Biclustering[J].International journal of environmental research and public health, 2021, Vol.18(8):4049. |